Синдром анорексии-кахексии у онкологических больных
Ключевые слов: синдром анорексии-кахексии, кахексия, анорексия.
Keywords: anorexia-cachexia syndrome, cachexia, anorexia.
А.В. Снеговой, И.Б. Кононенко, В.Б. Ларионова, А.И. Салтанов, В.Ю. Сельчук
ФГБНУ «Российский онкологический научный центр им. Н.Н. Блохина», Каширское ш., д. 24, Москва, Российская Федерация, 115478
Клиническая онкогематология 2015; 8(2): 185–190.
Полный текст статьи
ВВЕДЕНИЕ
Диагностика синдрома анорексии-кахексии у онкологических больных (САКОБ) — сложная клиническая задача. Это связано с тем, что для выработки адекватного плана лечения необходимо оценивать различные прокахектические факторы, которые в повседневной клинической практике, как правило, не учитываются.
Современное представление о патологических процессах, происходящих при синдроме анорексии-кахексии, знание классификации и своевременная диагностика помогают в выборе плана дифференцированной терапии, которую необходимо проводить при первых признаках развития САКОБ, а не в фазе развернутой клинической картины [1].
САКОБ — это многофакторный синдром с нарастающей потерей массы скелетной мускулатуры (с потерей жировой ткани или без нее) в результате снижения потребления пищи и дисбаланса метаболических процессов в организме, что сопровождается нарушениями белкового и энергетического обмена [1].Такие изменения являются необратимыми и приводят к прогрессивному ухудшению функционального статуса пациента. По данным статистики, 50 % онкологических больных умирают в результате развития синдрома анорексии-кахексии. При этом потеря массы тела более чем на 80 % происходит в последние 2 нед. жизни онкологического больного.
С 2000 г. САКОБ считают независимым маркером, определяющим выживаемость онкологических больных (табл. 1) [2, 3], особенно для пациентов с благоприятным прогнозом (хороший объективный статус, ранние стадии заболевания).
| Заболевание | Медиана выживаемости, нед | ||||
|---|---|---|---|---|---|
| Нет потери массы тела |
Потеря массы тела <5% |
Потеря массы тела 5-10 % |
Потеря массы тела > 10% |
ρ | |
| Немелкоклеточный рак легкого |
20 | 17 | 13 | 11 | <0,01 |
| Рак простаты | 46 | 30 | 18 | 9 | <0,05 |
| Колоректальный рак | 43 | 27 | 15 | 20 | <0,01 |
РАСПРОСТРАНЕННОСТЬ СИНДРОМА АНОРЕКСИИ-КАХЕКСИИ
По данным многочисленных исследований, распространенность синдрома анорексии-кахексии среди пациентов с диссеминированным раком составляет 60–80 %.
В группу высокого риска развития САКОБ относят пациентов с раком желудка и поджелудочной железы, т. к. именно при этих локализациях наиболее часто наблюдается синдром анорексии (рис. 1).

Рис. 1. Распространенность синдрома анорексии-кахексии у онкологических больных [4]
МРЛ — мелкоклеточный рак легкого; НМРЛ — немелкоклеточный рак легкого; НХЛ — неходжкинские лимфомы.
Несмотря на высокую частоту САКОБ и негативное влияние на выживаемость онкологических больных, диагностика этого синдрома остается неудовлетворительной.
ПАТОГЕНЕЗ СИНДРОМА АНОРЕКСИИ-КАХЕКСИИ
Основной патогенетический механизм развития синдрома анорексии-кахексии обусловлен многофакторными процессами. Реализация симптомов связана с воздействием медиаторов на органы-мишени в результате воспаления, с уменьшением потребления пищи, нарушением метаболизма. Все эти процессы приводят к потере мышечной ткани и массы тела. Патогенез синдрома анорексии-кахексии в виде схемы представлен на рис. 2.


Рис. 2. Общая схема патогенеза синдрома анорексии-кахексии [4–6]
IL-1 (-6) — интерлейкин-1 (-6); IFN-γ — интерферон-γ; TNF-α — фактор некроза опухолей α.
Опухоль и клетки-мишени (скелетная мускулатура, жировая ткань, иммунная система и печень) индуцируют воспалительный ответ, что сопровождается выделением медиаторов воспаления: фактора некроза опухолей (TNF-α), интерлейкинов (IL-6, IL-1). Было отмечено, что высокий уровень провоспалительных медиаторов определяется при многих опухолях. Остается неизвестным место продукции цитокинов: первичная опухоль или иммунная система. В результате воздействия медиаторов воспаления на головной мозг и другие органы развиваются такие клинические симптомы, как усталость, бессонница, изменение настроения, летаргия, депрессия, лихорадка, когнитивные нарушения, гипералгезия, снижение социальной адаптации.
Важную роль в патогенезе синдрома анорексиикахексии играет ускоренный катаболизм, возникающий преимущественно за счет прогрессирования опухоли, сопутствующей патологии, снижения физической активности, дефицита питания, побочных эффектов химиотерапии и др.
Катаболические процессы также связаны со снижением анаболизма за счет понижения уровня инсулиноподобного фактора 1-го типа и тестостерона.
Все это приводит к нерациональному использованию жировой и мышечной тканей, уменьшению мышечной массы и усилению усталости.
Потеря мышечной ткани
Потеря мышечной ткани — это патологический процесс, который возникает в результате мышечной атрофии. Объем мышечной ткани прогрессивно уменьшается и перерождается. Мышечные волокна постепенно истончаются, и в тяжелых случаях их количество резко уменьшается, иногда они полностью исчезают. Мышечная атрофия возникает в результате активности специфических молекул (миостатин, инсулиноподобный фактор 1-го типа) и протеасом (убиквитина), которые подавляют синтез белков и ускоряют процессы деградации мышечной ткани.
В норме убиквитин участвует в ремоделировании мышечной ткани за счет деградации «старого» мышечного белка. У онкологических больных происходит постоянная активация убиквитина из-за секреции цитокинов, что приводит к избыточной деградации и «выгоранию» мышечной ткани (рис. 3).
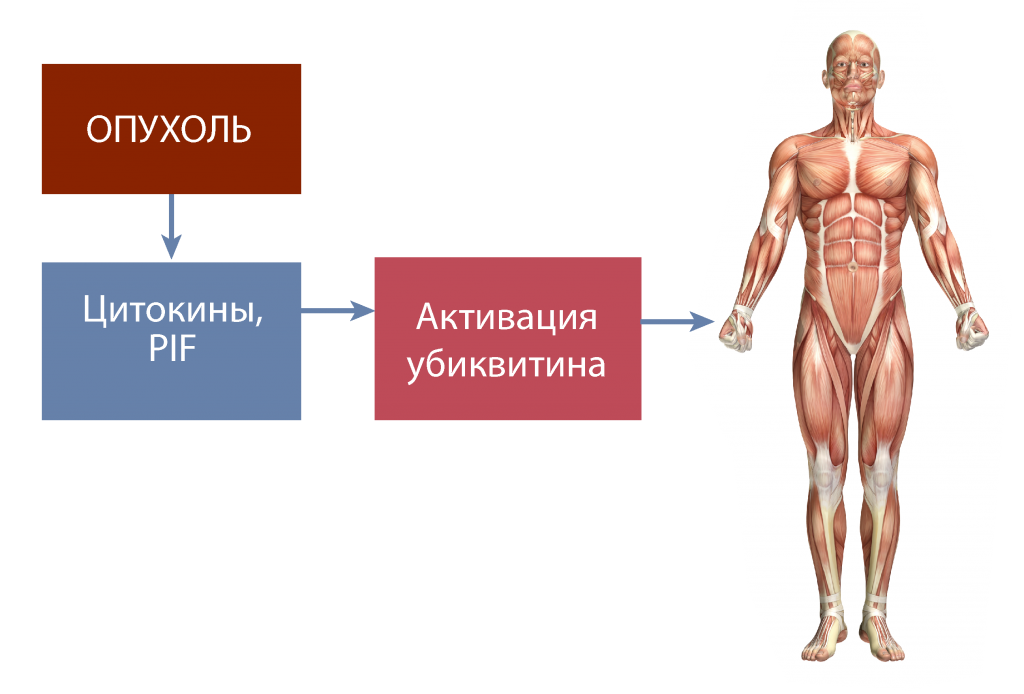
Рис. 3. «Выгорание» мышечной ткани [7]
PIF — фактор, индуцирующий протеолиз.
Отрицательное влияние также оказывает белок миостатин — цитокин, который в основном находится в мышечной ткани. Связываясь с рецептором активина II типа, этот белок стимулирует внутриклеточные каскады, которые тормозят мышечный рост и нарушают дифференцировку клеток.
Миостатин, в свою очередь, активируется инсулиноподобным фактором 1-го типа путем блокирования передачи сигнала с рецептора активина II типа. У онкологических больных баланс между миостатином и инсулиноподобным фактором 1-го типа, как правило, нарушен за счет гиперактивации миостатина, который блокирует инсулиноподобный фактор 1-го типа, в результате чего развивается мышечное истощение.
Потеря жировой ткани
Патологическая потеря жировой ткани происходит в результате ингибирования липогенеза и ускорения липолиза. В этом процессе задействован комплекс факторов, влияющих на снижение объема потребления пищи. Важную роль играют системный воспалительный ответ и липидмобилизирующий фактор, секретируемый опухолью. Кроме того, при синдроме анорексии-кахексии происходит гиперэкспрессия гормоночувствительной и триглицеридной липаз. В результате усиливается деградация жировой ткани с выделением в системный кровоток свободных триглицеридов и глицерола.
Нарушения нейрогенной регуляции
Передача сигналов между желудком и гипоталамусом — важный фактор развития анорексии у онкологических больных. В норме в гипоталамусе расположены центры голода и насыщения, которые возбуждаются гуморальными и рефлекторными влияниями. Ответственными нейропептидами являются лептин, контролирующий чувство насыщения, и грелин, активирующий чувство голода. Эти два нейромедиатора вырабатываются в желудке и передают сигналы в гипоталамус к рецепторам нейропептида Y, позволяющего контролировать прием пищи. Нарушение аппетита у онкологических больных связано с тем, что опухолевые цитокины имитируют сигнал, подобный лептину, в результате чего постоянно присутствует чувство насыщения и подавляется активность грелина. В результате возникает анорексия, которая приводит к компенсаторной кахексии.
СКРИНИНГ СИНДРОМА АНОРЕКСИИ-КАХЕКСИИ
Схема алгоритма определения группы риска представлена на рис. 4.

Рис. 4. Алгоритм определения группы риска [8]
ОЦЕНКА СИНДРОМА АНОРЕКСИИ-КАХЕКСИИ
Ключевые клинические симптомы, которые необходимо оценить у онкологического больного для предотвращения развития кахексии и рефрактерной кахексии, представлены на рис. 5 [8].
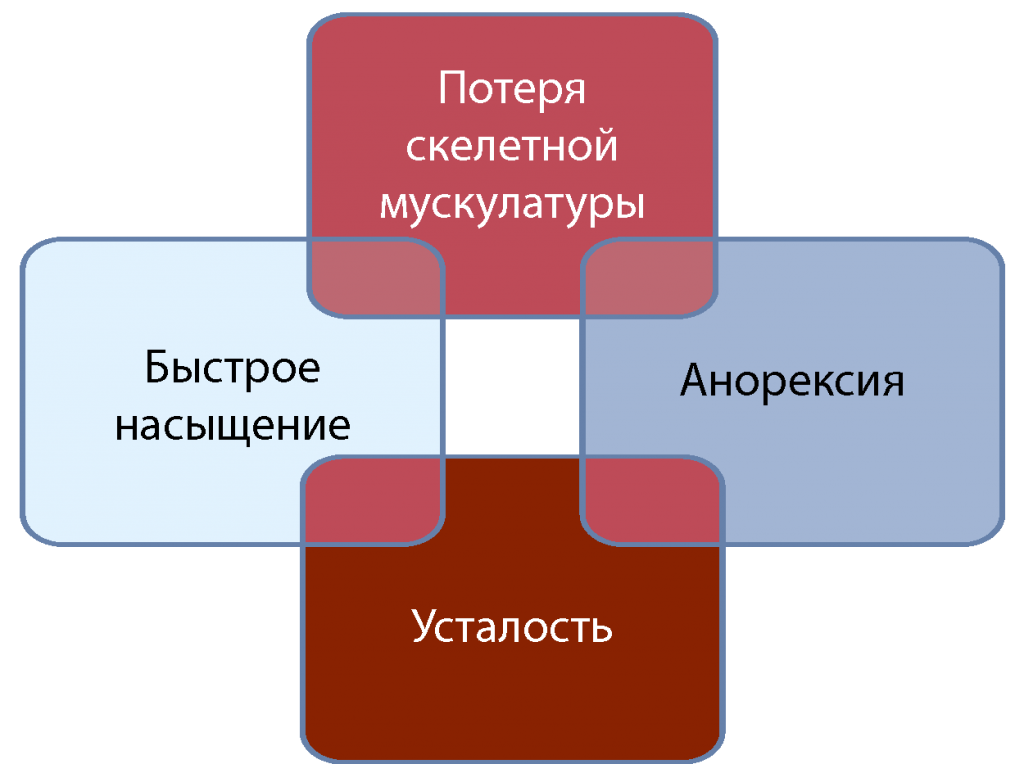
Рис. 5. Ключевые клинические симптомы [8]
Анорексия. Одним из основных предвестников кахексии является анорексия, которая связана с уменьшением объема потребляемой пищи (например, нарушение вкуса и обоняния, снижение гастроинтестинальной моторики: тошнота, рвота, быстрое насыщение, запор и др.). Объем потребления пищи должен оцениваться регулярно, особенно количество белка и калорий.
Катаболизм. Комплекс нарушений, обусловленных использованием тканевых белков для покрытия высоких энерготрат (в первую очередь, мышечных) и липидов из жировых депо. Этот процесс происходит преимущественно за счет опухолевого метаболизма, системного воспаления, а также других опухоль-ассоциированных эффектов.
Наиболее распространенным методом оценки степени гиперкатаболизма является анализ уровня С-реактивного белка, что определяет выраженность белкового истощения. Мониторинг С-реактивного белка позволяет своевременно предотвратить развитие питательной недостаточности, а также осуществлять контроль проводимой нутритивной поддержки.
Этот показатель мало информативен при прогрессировании заболевания или на фоне проведения химиотерапии, когда процесс катаболизма не сопровождается повышением С-реактивного белка.
Физический и психологический статус. Важными показателями физического и психологического статуса пациента служат оценка по критериям ECOG, индекс Карновского, опросник EORTC QLQ C-30. Необходимо оценить, насколько физическое и психологическое состояния пациента влияют на способность принимать необходимый объем пищи и скорость потери массы тела.
Объективный осмотр. Следует обратить особое внимание на тургор кожи, наличие отеков, степень обезвоживания, провести осмотр полости рта.
Также нужно оценить индекс массы тела (пациенты с ожирением — высокая группа риска!), при возможности провести динамометрию. Необходимость выполнения динамометрии связана с тем, что индекс массы тела может давать ложноотрицательный результат. Пациенты с ожирением имеют высокий индекс массы тела, следовательно, критерий снижения массы тела теряет свое диагностическое значение, что приводит к «ложной» уверенности об отсутствии синдрома анорексии-кахексии (рис. 6).

Рис. 6. Компьютерная томограмма структуры тканей у онкологических больных с одинаковым индексом массы тела (30,3 кг/м2) и площадью поверхности тела (2,07 м2) [9]. Мышечная ткань указана красным цветом
Лабораторные показатели. Необходимо оценить следующие показатели: лейкоциты, эритроциты, гемоглобин, тромбоциты, уровень С-реактивного белка, глюкозы, мочевины и креатинина, аланинаминотрансферазы, аспартатаминотрансферазы, общего билирубина.
СТАДИИ СИНДРОМА АНОРЕКСИИ-КАХЕКСИИ
В настоящее время выделяют три стадии процесса.
I. Прекахексия: потеря массы тела (вычисляется как процент от массы тела до заболевания) не более 5 % за последние 6 мес., признаки системного воспалительного ответа, анорексия и метаболические изменения.
II. Кахексия: потеря массы тела более 5 % за последние 6 мес. (при условии, что пациент не голодал намеренно!), или продолжающаяся потеря массы тела более 2 %, или индекс массы тела менее 20 кг/м2, или потеря скелетной мускулатуры, сопровождающаяся снижением массы тела более 2 %. Признаки системного воспалительного ответа, анорексия, снижение потребления объема пищи.
III. Рефрактерная кахексия: критерии кахексии на фоне выраженного катаболизма, отсутствие эффекта от проводимой противоопухолевой терапии, оценка по ECOG 3–4 балла, ожидаемая продолжительность жизни менее 3 мес.
Определение стадии синдрома анорексии-кахексии, необходимо для назначения терапии [9, 10].
ЛЕЧЕНИЕ СИНДРОМА АНОРЕКСИИ-КАХЕКСИИ
При определении алгоритма лечения (рис. 7) прежде всего необходимо выделить патогенетический фактор, который считается основным в развитии САКОБ у каждого конкретного пациента:
- анорексия и снижение объема питания;
- катаболизм;
- потеря скелетной мускулатуры;
- нарушение физического и психологического статуса.

Рис. 7. Общий алгоритм лечения синдрома анорексии-кахексии у онкологических больных
Лечение таких пациентов необходимо начинать с выбора нутритивной поддержки — процесса обеспечения адекватного питания с помощью ряда методов, отличных от обычного приема пищи, включающих в себя парентеральное, энтеральное питание или их комбинацию (энтеральное + парентеральное).
При выборе типа питания необходимо учитывать, что парентеральное питание увеличивает риск инфекционных и метаболических осложнений. Энтеральное питание не всегда компенсирует суточные потребности в калориях из-за вкусовой инверсии или анорексии у этой категории пациентов. Однако именно этот тип питания позволяет сохранить слизистый барьер, обеспечить иммунную защиту кишечника и способствует поддержанию физиологических сигналов между ЖКТ и гипоталамусом.
Энтеральное питание связано с минимальным спектром побочных эффектов [11–13].
При выборе энтерального питания наиболее предпочтительны высокобелковые малообъемные препараты (например, нутридринк-компакт протеин и др.).
Важную роль в лечении синдрома анорексии-кахексии играют стимуляторы аппетита — синтетические прогестины, которые используются только в комплексной терапии (мегестрола ацетат в дозе 160–1600 мг в сутки и медроксипрогестерон 300–4000 мг в сутки) [14]. Эти препараты у 5 % пациентов могут вызывать побочные эффекты: кожную сыпь, нарушение менструального цикла, недостаточность функции надпочечников, гипергликемию, тромбозы.
Для коррекции анорексии также используют кортикостероиды. Дозы дексаметазона варьируют от 4 до 8 мг/сут, метилпреднизолон — 12 мг в сутки, преднизолон — 15 мг в сутки. Эффективность этих препаратов реализуется в течение первых 2 нед. Кроме того, следует учитывать спектр нежелательных явлений кортикостероидов: миопатия, уменьшение тургора кожных покровов, недостаточность надпочечников, резистентность к инсулину, бессонница и когнитивные нарушения [15].
Каннабиноиды (дронабинол) — лекарственные препараты, которые стимулируют аппетит и обладают противорвотным свойством. Назначаются по 2,5 мг 3 раза в сутки в течение 4 нед. Осложнения: эйфория, галлюцинации, психозы, кардиоваскулярные нарушения.
Коррекция метаболических расстройств происходит за счет добавления жирных кислот, например применения омега-3. Это способствует ослаблению мышечного протеолиза, положительно влияет на жировой и белковый метаболизм. Омега-3-полиненасыщенные жирные кислоты назначают в дозе около 2 г в сутки.
В комплексное лечение САКОБ необходимо включить препарат, нормализующий энергетические процессы в клетке, — гидразина сульфат, который назначается по ступенчатой схеме: 1-й день — 60 мг, 2-й день — по 60 мг 2 раза в сутки, начиная с 3-го дня — по 60 мг 3 раза в сутки.
В настоящее время также исследуются другие препараты, способные влиять на метаболические процессы: анаморелин (агонист рецепторов грелина), селективные модуляторы андрогеновых рецепторов, ингибиторы миостатина, пептидные иммуномодуляторы (OHR118). Из немедикаментозных средств исследуется эффективность низкоантиоксидантных диет, белого вина, ферментированного соевого напитка.
Не все клинические исследования оказались успешными в этой области. Например, оценка фитотерапии, мелатонина, трициклических антидепрессантов, пероральных разветвленных аминокислот, пентоксифиллина не доказала их эффективности в лечении САКОБ.
Несмотря на широкий спектр препаратов, применяемых для лечения синдрома анорексии-кахексии, адекватное лечение не может считаться полноценным без привлечения врачей других специальностей (психолога или психиатра, специалиста по противоболевой терапии, гастроэнтеролога и др.).
Для успешной терапии следует выполнить коррекцию факторов, которые опосредованно влияют на развитие или прогрессирование синдрома анорексии-кахексии. Необходимым считается проведение противоболевой терапии, назначение гастрокинетиков и антиэметиков (с осторожностью!), ферментных препаратов, гепатопротекторов, препаратов для лечения анемии (внутривенные препараты железа, витамин В12, фолиевая кислота), слабительных и антидиарейных средств.
С каждым пациентом следует обсудить возможность выполнения физических упражнений, стимуляции аппетита.
ЗАКЛЮЧЕНИЕ
ЛИТЕРАТУРА / REFERENCES
1. Кононенко И.Б., Ларионова В.Б., Манзюк Л.В. и др. Синдром анорексии-кахексии. В кн.: Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO). Под ред. В.М. Моисеенко. М.: Общество онкологов-химиотерапевтов, 2014: 399–402. [Kononenko I.B., Larionova V.B., Manzyuk L.V. et al. Cahexia-anorexia syndrome. In: Moiseenko V.M., ed. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu zlokachestvennykh opukholei (RUSSCO). (Practical guidelines for drug therapy of malignancies (RUSSCO).) Moscow: Obshchestvo onkologovkhimioterapevtov Publ., 2014. pp. 399–402.]
2. DeVita V.T. Jr., Lawrence T.S., Rosenberg S.A. Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia: Lippincott Williams & Wilkins, 2011.
3. Dewys W.D., Begg C., Lavin P.T., Band P.R. et al. Prognostic effect of weight loss prior to chemotherapy in cancer patients. Eastern Cooperative Oncology Group. Am. J. Med. 1980; 69(4): 491–7.
4. Del Fabbro E., Inui A., Strasser F. Cancer Cachexia. Pocket book for cancer supportive care. Springer Healthcare, 2012.
5. Снеговой А.В. Школа «Поддерживающей терапии в онкологии». 2014. http://www.rosoncoweb.ru/events/2014/12/05/ [Snegovoi A.V. Maintenance Therapy in Oncology School. 2014. http://www.rosoncoweb.ru/events/2014/12/05/]
6. Hamid R.A.H., Umbas R., Mochtar C.A. Recent role of inflammation in prostate diseases: chemoprevention development opportunity. Acta Med. Indones-Indones. J. Intern. Med. 2011; 43(1): 59–65.
7. Argiles J.M., Busquets S., Garcia-Martonez C., Lopez-Soriano F.J. Mediators involved in the cancer anorexia-cachexia syndrome: past, present, and future. Nutrition. 2005; 21(9): 977–85.
8. Materials of conference of the Multinational Association of Supportive Care in Cancer (MASCC), June 2014. J. Sup. Care Cancer. 2014; 22(Suppl. 1): 28–31.
9. Fearon K., Strasser F., Anker S.D. et al. Definition and classification of cancer cachexia: an international consensus. Lancet Oncol. 2011; 12: 489–95.
10. Evans W.J., Morley J.E., Argiles J. et al. Cachexia: a new definition. J. Clin. Nutr. 2008; 27(6): 793–9.
11. Daley R.J., Canada T. Managing the cancer anorexia-cachexia syndrome: a pharmacologic review. Oncol. Nutr. Connect. 2004; 12(4): 1–6.
12. Bosaeus I. Nutritional support in multimodal therapy for cancer cachexia. Sup. Care Cancer. 2008; 16: 447–51.
13. Thoresen L., Frykholm G., Lydersen S. et al. Nutritional status, cachexia and survival in patients with advanced colorectal carcinoma. Different assessment criteria for nutritional status provide unequal results. Clin. Nutr. 2013; 32: 65–72.
14. Baldwin C., Spiro A., McGough C. et al. Simple nutritional intervention in patients with advanced cancers of the gastrointestinal tract, non-small cell lung cancers or mesothelioma and weight loss receiving chemotherapy: a randomised controlled trial. J. Hum. Nutr. Diet. 2011; 24: 431–40.
15. Maltoni M., Nanni O., Scarpi E. High-dose progestins for the treatment of cancer anorexia-cachexia syndrome: A systematic review of randomised clinical trials. Ann. Oncol. 2001; 12: 289–300. ONCO_