Оптимизация анальгетической терапии в паллиативной онкологии. Клинические и фармакоэкономические аспекты применения гидразина сульфата (СЕГИДРИНА)
Ключевые слова: паллиативная медицинская помощь, адекватное обезболивание, опиоидные анальгетики, опиоидная толерантность, хроническая боль, полипрагмазия, гидразина сульфат, фармакоэкономические аспекты
palliative therapy.
Keywords: palliative care, adequate pain control, opioid analgesics, opioid tolerance, chronic pain, polypharmacy, hydrazine sulfate, pharmacoeconomic aspects
Палехов А.В., Введенская Е.С., Койчуев А.А., Гулиева Л.А., Шаллаева Е.И.
Журнал «Паллиативная медицина и реабилитация» № 2, 2019
Об авторах
Введенская Е.С. – к.м.н., зав. отделением амбулаторной паллиативной медицинской помощи ГБУЗ НО «Городская клиническая больница № 30 Московского района г. Нижнего Новгорода»; зав. курсом «Паллиативная медицинская помощь» в ГАОУ ДПО «Нижегородский областной центр повышения квалификации специалистов здравоохранения»
Койчуев А.А. – д.м.н., исполняющий обязанности заведующего кафедрой онкологии и лучевой терапии с курсом ДПО ГБОУ ВПО «Ставропольский государственный медицинский университет», заместитель главного врача ГБУЗ СК «Ставропольский краевой клинический онкологический диспансер»
Гулиева Л.А. – к.м.н., ассистент кафедры онкологии и лучевой терапии с курсом ДПО ГБОУ ВПО «Ставропольский государственный медицинский университет»
Шаллаева Е.И. – Врач-онколог, заведующая службой паллиативной медицинской помощи ГБУЗ СК «Кочубеевская РБ»
В последние годы в России, как и во всем мире, растет онкологическая заболеваемость. Злокачественные новообразования (ЗНО) являются одной из основных причин смерти населения. Так, по данным статистики, в 2017 г. в нашей стране от ЗНО умерли 289 000 человек. Несмотря на предпринимаемые меры, были выявлены в запущенной стадии (IV) в 2017г. 20,2% ЗНО [9].
Тяжесть состояния инкурабельных онкологических пациентов обусловлена многочисленностью и поливалентностью проявлений патологического процесса, а в ряде случаев и последствиями агрессивных методов лечения, в связи с чем показано одновременное применение различных групп лекарственных средств, оказывающих влияние на различные патологические факторы. Отсюда следует, что значимой проблемой в терапии онкологических пациентов и, особенно, при оказании им паллиативной медицинской помощи (ПМП) является вынужденная полипрагмазия и, соответственно, появление проблем взаимодействия и совместимости лекарственных препаратов.
По данным различных авторов, одно из лидирующих мест в списке тягостных симптомов, которыми страдают пациенты с диагнозом ЗНО, занимает хронический болевой синдром (ХБС), наивысшая интенсивность и распространённость которого отмечается при генерализации процесса [4, 14, 15, 18-20].
Так, результаты проведенного в России в 2018 г. первого эпидемиологического исследования потребности онкологических пациентов в ПМП показали, что ХБС, вне зависимости от его интенсивности, встречался у 71,00% респондентов. При этом, по оценке врачей, на умеренную и сильную боль, требующую назначения опиоидных анальгетиков (ОА), жаловались 50,91% (32,51% и 18,4% соответственно) опрошенных пациентов, подавляющее большинство из которых нуждалось в длительном применении этих лекарственных препаратов [4].
С целью повышения качества анальгетической терапии в последние несколько лет Минздравом России внесены многочисленные изменения в нормативные акты в сфере использования сильнодействующих наркотических и психотропных лекарственных средств, что сегодня дает возможность врачам избавлять пациентов от страданий и своевременно назначать опиоидные препараты, соответствующие интенсивности боли. Важно отметить, что при этом, как правило, увеличивается период применения этих лекарственных средств.
Кроме того, развитие специальных методов лечения позволило значительно увеличить продолжительность жизни онкологических пациентов, что в свою очередь также может способствовать продлению периода использования ОА. Таким образом, в настоящее время, всё более значимой становится проблема роста анальгетических доз наркотических средств (НС), связанная с ростом опиоидной толерантности1, обусловленной длительным применением этих препаратов. Рост анальгетических доз, в свою очередь, увеличивает риск развития нежелательных побочных эффектов, снижая тем самым качество обезболивания [13, 16, 17, 21].
На рисунке отчётливо видно, что по данным проведенных исследований, повышение доз ОА, отражённое в эквивалентных дозах стандарта сравнения морфина, приводит к многократному увеличению нежелательных побочных эффектов (рис.1). Таким образом, поиск путей, препятствующих росту эффективных доз НС и, особенно, при их длительном применении, сегодня становится одним из важнейших направлений повышения качества анальгетической терапии.
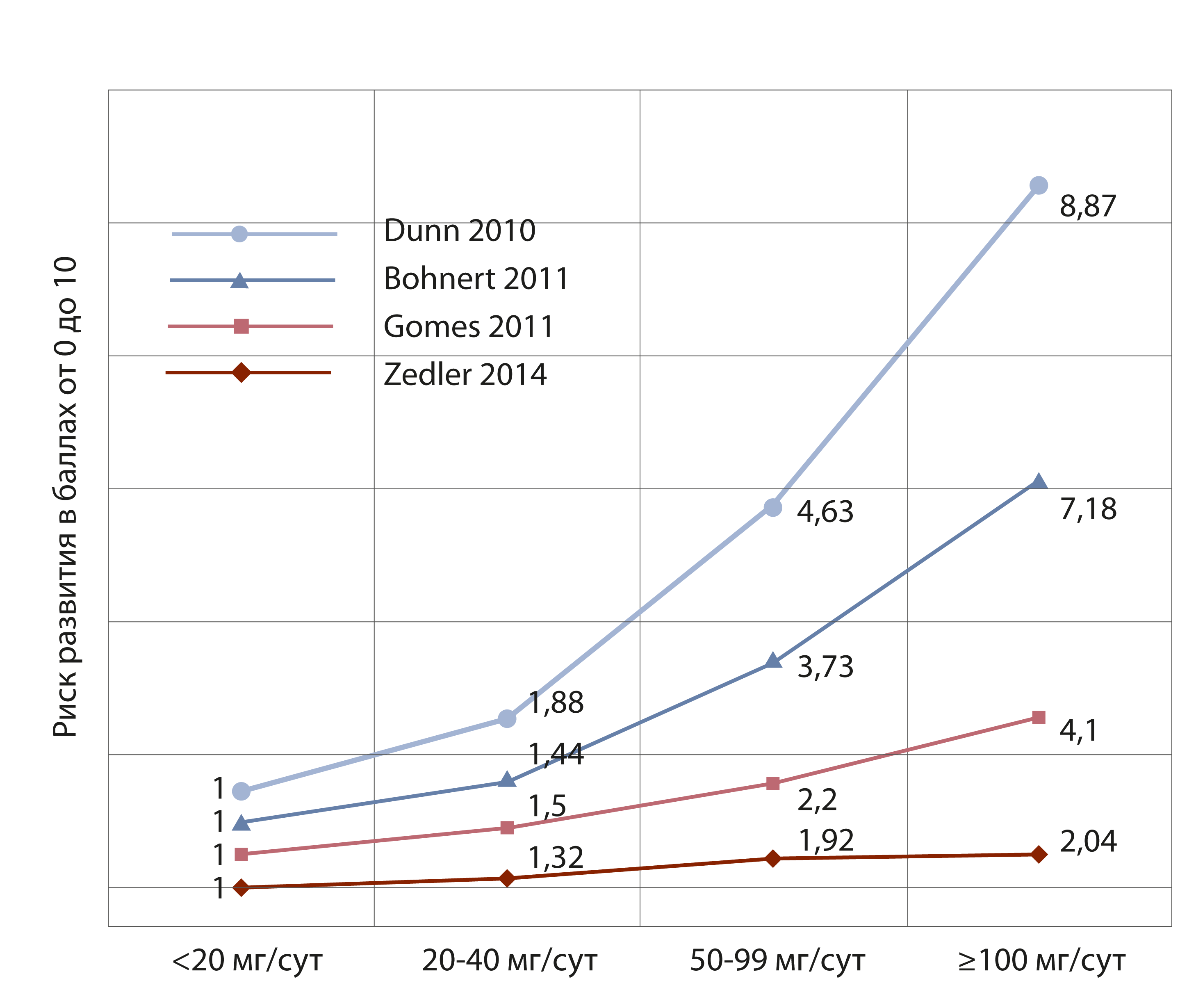
в зависимости от дозы по данным иностранных авторов (эквивалент дозы морфина, мг/сутки)
Ещё в 2004 г. основоположником российской школы анальгетической терапии профессором Н.А.Осиповой с соавторами были созданы методические указания, ставшие впоследствии основой для издания всех руководств, посвящённых указанной тематике, в которых отражался один из основных принципов клинического применения НС: «Монотерапия наркотиками любых болевых синдромов (в том числе самых сильных) нецелесообразна. В целях повышения эффективности и безопасности обезболивания наркотик следует сочетать с ненаркотическими анальгетическими и адъювантными компонентами, избираемыми в соответствии с патогенезом конкретного болевого синдрома» [3].
Необходимость комбинации НС со вспомогательными (адъювантными) анальгетиками для потенцирования обезболивающего эффекта и целенаправленного воздействия на различные механизмы развития хронической боли не вызывает сомнения, но указанная тактика, в свою очередь, может приводить к вынужденной полипрагмазии. Следовательно, с целью повышения эффективности проводимой терапии необходимо искать способы снижения скорости развития опиоидной толерантности, избегая при этом вынужденной полипрагмазии.
В настоящее время имеется ряд исследований, которые показывают эффективность включения в схему терапии пациентов с распространенными формами ЗНО гидразина сульфата (Сегидрина), что способствует решению вышеуказанных проблем.
Не останавливаясь на механизмах действия этого препарата, отражённых как в инструкции по применению2, так и в работах различных авторов [2, 5, 10-12], необходимо отметить, что гидразина сульфат (ГС) относится к фармакологической группе противоопухолевых средств, но нас, как и других исследователей, интересовала способность этого оригинального препарата оказывать выраженное симптоматическое действие.
Ряд авторов изучали влияние ГС на качество жизни онкологических пациентов, которым в связи с прекращением всех видов радикального лечения было показано только проведение ПМП. Как показали результаты проведенных исследований, применение ГС приводит к следующим терапевтическим эффектам:
– снижение интенсивности боли;
– уменьшение чувства слабости;
– уменьшение явлений дыхательной недостаточности (одышки, кашля);
– уменьшение лихорадки;
– улучшение аппетита, повышение двигательной активности;
– улучшение общего самочувствия, повышение настроения [2, 5, 10-12].
Крайне важно, что, в соответствии с инструкцией, ГС применяется при местнораспространенных и диссеминированных формах ЗНО, в том числе у пациентов с цитопениями, обусловленными химио– и лучевой терапией, а также и при желтухе, в том числе и обтурационной, вызванной метастазами в печень (для улучшения самочувствия пациента).
Учитывая поливалентность воздействия ГС на различные звенья патологических процессов и хорошую лекарственную совместимость, данный препарат достаточно часто включался нами в схемы паллиативной терапии инкурабельных онкологических пациентов.
Как показали результаты ранее проведенного нами исследования, отмечается чёткая взаимосвязь между применением ГС у инкурабельных онкологических пациентов и снижением интенсивности боли, что позволяет уменьшить дозы, а, в ряде случаев, отменить применяемые ОА [6].
В данное исследование были включены 63 онкологических пациента IV клинической группы с ХБС (интенсивность боли по ВАШ3 от 4 до 7 баллов), которым было показано проведение только симптоматической терапии. До начала исследования пациенты были рандомизированы в две группы: 1-я группа, исследуемая, в схему паллиативной терапии был включен ГС (31 пациент); 2-я группа, контрольная4 – проводилась паллиативная терапия без ГС (32 пациента). Оценка интенсивности боли и коррекция анальгетической терапии в обеих группах проводилась каждые 10 суток (и кроме того, при дополнительных жалобах пациента на повышение интенсивности боли – в момент обращения).
Интенсивность болевого синдрома и динамика изменения доз ОА существенно различались у пациентов первой и второй групп. В начале исследования интенсивность ХБС в обеих группах соответствовала градации «умеренная боль», и средняя суточная доза трамадола на фоне рациональной неопиоидной анальгетической терапии в сочетании с симптоматическими средствами составляла 263,5 ± 4,7 мг/сут.
В 1-й группе к концу исследования (через 3 мес.) у 45,2% пациентов интенсивность боли снизилась, и соответственно уменьшилась доза трамадола, в том числе у 19,4% пациентов уже через месяц использования ГС болевой синдром уменьшился до градации «слабая боль», и трамадол был отменен.
В группе контроля (2-я группа) у всех пациентов отмечался рост доз трамадола и повышалась потребность в адъювантной терапии. В связи с недостаточной эффективностью трамадола более трети пациентов (38,1%) данной группы были переведены на терапию сильными (наркотическими) опиоидами.
Таким образом, можно сделать заключение о том, что у пациентов, получавших ГС, снижение доз ОА и, соответственно, скорости роста опиоидной толерантности, наблюдалось в целом в 83,3% случаев: ни одному пациенту не были назначены НС (в то время как 38,1% пациентов контрольной группы были переведены на сильные опиоиды), и у 45,2% была снижена доза трамадола, или препарат был отменен.
Кроме того, у всех пациентов в той или иной степени уменьшилась другая патологическая симптоматика, требующая дополнительной терапии, что позволило минимизировать уровень вынужденной полипрагмазии. Необходимо отметить, что общая слабость уменьшилась в 58,0% случаев, в 64,5% случаев отмечалось улучшение психоэмоционального состояния. На фоне приема ГС было отмечено снижение потребности в симптоматических средствах в 85,0 % случаев [6].
Полученные данные коррелируют с результатами открытого рандомизированного исследования применения ГС у пациентов с генерализованными формами ЗНО, получавших опиоидные анальгетики, проведенного в России в 2017 году на двух клинических базах5 [1].
При оценке изменения интенсивности боли (ИБ)6 у пациентов на фоне приема ГС авторами этого исследования было выявлено, что через 28 дней терапии ИБ снизилась с 58,08±10,82% (средний показатель ИБ до терапии ГС) до 48,25±12,24% (р<0,05) у 70,0% пациентов. Полученный результат, с учетом особенностей исследуемого контингента пациентов, расценивается авторами как хороший. Анализ показал, что в целом имело место достоверное снижение ИБ через 28, 42 и 70 дней после начала терапии. Среди пациентов, отметивших снижение ИБ, у 25,0% ИБ по НОШ уменьшилась на 20,0% и более, а у 13,0% пациентов – на 30,0% и более. Авторы делают заключение о том, что около половины пациентов, принимавших ГС, к концу исследования снизили дозу трамадола, при этом 25,0% уменьшили его прием в 2 раза, а 12,0% полностью прекратили применение [1].
Таким образом, анализируя результаты двух представленных вашему вниманию исследований, можно сделать выводы о том, что применение ГС при умеренной и начальных стадиях сильной хронической боли (4-7 баллов по ВАШ) позволяет не только в 70,0-80,0% случаев предотвратить рост опиоидной толерантности (значительно возросший в контрольной группе), но и уменьшить интенсивность ХБС у онкологических пациентов в среднем на 2 балла по ВАШ на фоне снижения потребности в адъювантных и симптоматических средствах у 85,0% пациентов.
Анализируя фармакоэкономические аспекты применения ГС у онкологических пациентов, авторы пришли к выводу, что в данном контексте изучению подлежат следующие параметры:
– экономия средств за счет отказа от назначения НС (в отличие от группы контроля), обусловленного снижением/предотвращением роста опиоидной толерантности на фоне применения ГС;
– экономия средств за счет снижения суточных доз уже применяемых пациентами ОА;
– снижение стоимости терапии, связанное с уменьшением применения адъювантных и симптоматических средств.
При анализе снижения стоимости терапии за счёт уменьшения применения адъювантных и симптоматических средств необходимо учитывать, что диапазон применяемых препаратов достаточно велик, как по номенклатуре (антиконвульсанты, антидепрессанты, центральные миорелаксанты, слабительные, противорвотные и целый ряд других препаратов), так и по используемым дозировкам и, соответственно, разброс цен, определяющих снижение данного параметра затрат, крайне вариабелен.
Поэтому для проведения оценки снижения стоимости терапии за счет уменьшения использования симптоматических средств на фоне приема ГС требуется в дальнейшем детальное изучение спектра и доз, применяемых симптоматических лекарственных препаратов, как до начала, так и на фоне применения ГС.
Расчёт снижения стоимости терапии, связанного с непосредственным уменьшением доз ОА на этапе применения трамадола, проводится исходя из результатов, приведенных выше исследований (снижение дозы трамадола в 2 раза у 25,0% пациентов и прекращение его приема у 12,0% [1] и у 19,0% пациентов [1, 6]).
В настоящее время наиболее актуален анализ уменьшения затрат на терапию, обусловленного замедлением роста опиоидной толерантности. Если ранее мы могли сравнивать затраты на терапию, сопоставляя между собой стоимость различных лекарственных форм наркотических средств [7], но при этом не имея узаконенных нормативов для расчёта кратности применения каждой формы, то на сегодняшний день порядок этого расчёта определяется регламентирующими документами Минздрава РФ.
Приказом Минздрава РФ, определяющим расчет потребности в наркотических лекарственных средствах, указано, что неинвазивные пролонгированные лекарственные формы должны составлять не менее 75%7 от общей потребности в НС, применяемых онкологическими пациентами [8]. Таким образом, для длительной терапии должны использоваться именно пролонгированные лекарственные формы НС. Кроме того, определены конкретные препараты, рекомендуемые для применения, и соотношение их дозировок между собой.
Основываясь на утверждённой приказом Минздрава РФ методике, мы провели расчет стоимости месячной терапии каждым из определённых приказом НС (ТТС с фентанилом и таблеток продлённого действия – морфина сульфата, оксикодона/налоксона) и сравнили полученные результаты со стоимостью месячной терапии трамадолом в комбинации с ГС.
Исходя из средневзвешенной цены8 одной упаковки (таблетки 60 мг № 50) ГС, равной 3404 руб., и среднемесячного курса использования ГС из расчёта 1,5 упаковки9, средняя цена такого курса составит 5100 рублей. При средневзвешенной цене10 упаковки трамадола (таблетки 100 мг № 20), равной 150 руб., стоимость месячного курса трамадолом (в максимальной дозе 400 мг/сут.) из расчёта 6 упаковок в месяц, составит 900 руб.
Таким образом, стоимость месячного курса терапии трамадолом в максимальной дозе в комбинации с ГС составит 6000 рублей.
В то же время, исходя из официальных рекомендаций и собственного опыта, перевод пациента на наркотические анальгетики в дозе, которая, при росте ИБ должна превысить анальгетический эффект максимальной дозы трамадола, составит следующую минимальную потребность:
– ТТС с фентанилом – в начале месяца 25 мкг/час, во второй половине месяца 50 мкг/час. В сумме это составит одну упаковку ТТС с фентанилом 25 мкг/час (5 пластырей) и одну упаковку ТТС с фентанилом 50 мкг/час (5 пластырей);
– морфина сульфат, таблетки пролонгированного действия – в начале месяца 60 мг/сут. во второй половине месяца 120 мг/сут. Итого, две упаковки, табл. 30 мг. № 20 и одна упаковка, табл. 60 мг № 20;
– оксикодон+налоксон, таблетки пролонгированного действия – в начале месяца 40/20 мг/сут. во второй половине месяца 80/40 мг/сут. Итого, две упаковки, табл. 20/10 мг № 20 и одна упаковка, табл. 40/20 мг № 20 (таблица).
Таблица
| Препарат | ТТС с фентанилом | Морфина сульфат таблетки пролонгированного действия |
Оксикодон + налоксон таблетки пролонгированного действия |
|||
|---|---|---|---|---|---|---|
| Доза | 25 мкг/час | 50 мкг/час | 30 мг | 60 мг | 20/10 мг | 40/20 мг |
| Цена упаковки (руб.) | 2971 | 4403 | 1800 | 3369 | 2466 | 3980 |
| Стоимость месячного курса терапии | 2971 + 4403 = 7374 | 1800×2 + 3369 = 6969 | 2466×2 + 3980 = 8912 | |||
| Разница в стоимости по сравнению с терапией трамадол + гидразина сульфат* |
7374 – 6000 = 1374 | 6969 – 6000 = 969 | 8912 – 6000 = 2912 | |||
Немаловажно, что повышение качества жизни пациента повышает качество жизни и членов его семьи. Таким образом, целесообразность использования ГС в комплексной терапии при оказании ПМП онкологическим пациентам не вызывает сомнения, а фармакоэкономические аспекты применения данного препарата позволяют значительно увеличить его использование у пациентов указанного профиля.
Так, в Ставропольском крае ГС (наряду с неинвазивными пролонгированными лекарственными формами ОА) включен в перечень препаратов льготного лекарственного обеспечения онкологических пациентов за счёт краевых финансовых средств.
Собственный опыт применения ГС указывает на то, что оптимальные результаты его использования отмечаются у пациентов, ведущих умеренно активный образ жизни и, следовательно, целесообразно более раннее начало его назначения. Мы не ставили перед собой задачи выяснения механизмов действия ГС, которые обусловливают его терапевтические эффекты. Учитывая, что эти механизмы могут быть связаны не только с улучшением параметров гомеостаза, влияющих на самочувствие пациента, но и, возможно, с замедлением роста опухоли, целесообразно проведение исследований по применению ГС в сочетании с современными препаратами, используемыми для специализированной терапии в онкологии.
Сноски продублированы внутри текста и появляются при наведении курсора на ту часть текста, к которому относятся.
Сноски
1 Толерантность в фармакологии – снижение реакции организма на повторяющееся поступление препарата, ввиду чего требуется всё большая и большая доза для достижения присущего веществу эффекта (в нашем случае – анальгетического).
2 Инструкция по медицинскому применению: https://www.rlsnet.ru/tn_index_id_5675.htm
3 Визульно-аналоговая шкала оценки интенсивности боли (баллы от 0 до 10).
4 Группы пациентов были сопоставимы по основным прогностическим факторам.
5 ФГБУ «Федеральный медицинский исследовательский центр имени П.А. Герцена» Министерства здравоохранения Российской Федерации и ГБУЗ Ставропольского края «Кочубеевская районная больница» совместно с ФГБОУ ВО
«Ставропольский государственный медицинский университет», кафедра онкологии.
6 Оценка боли проводилась по НОШ – нумерологической оценочной шкале интенсивности боли (от 0 до 100%).
7 Приказом Минздрава России от 16 ноября 2017 г. № 913 утверждена следующая методика расчёта: из 80% пациентов, нуждающихся в НС, 60% нуждаются в неинвазивных пролонгированных лекарственных формах НС, таким образом, потребность в этих лекарственных формах составляет 6/8 или 75% от общей потребности в НС, применяемых пациентами со ЗНО.
8 Минимум по полю – цена за упаковку (контракт) 2831 руб., максимум по полю – цена за упаковку (контракт) 4633 руб.
9 Кратность применения гидразина сульфата в исследованиях 2 или 3 таблетки в сутки.
10 Предельная оптовая цена, для организации на ОСН руб., с НДС: Таблетки 100 мг №20 ООО «Пранафарм» – Россия – 89,83 руб.; Таблетки 100 мг №20 ООО «Озон» – Россия – 203,69 руб.
11 ОСН – общая система налогообложения.
12 Зарегистрированные цены на лекарственные препараты, включенные в перечень жизненно необходимых и важнейших лекарственных препаратов по состоянию на 30.04.2019 г. http://mz26.ru/action/priceznvls/
13 Продолжительность применения ГС инструкцией не ограничена.
Литература
1. Абузарова Г.Р., Алексеева Г.С., Сарманаева Р.Р., Лапина С.Е. Сегидрин как препарат сопроводительной терапии для повышения качества жизни и уменьшения хронического болевого синдрома у онкологических пациентов паллиативного профиля. Фарматека. 2018; 12: 40-45.
2. Зайдинер Б.М. Сегидрин в паллиативной онкологии. Фарматека 2003; 14(77): 66–70.
3. Методические указания МЗ РФ N 819 «Принципы клинического применения наркотических и ненаркотических анальгетических средств при острой и хронической боли»). М., 2004.
4. Новиков Г.А., Введенская Е.С., Зеленова О.В. с соав. Результаты первого в России эпидемиологического исследования потребности онкологических пациентов в паллиативной медицинской помощи и оценка эффективности и безопасности методов диагностики патологических симптомов. Паллиативная медицина и реабилитация. 2018; 4: 5-10
5. Новиков Г.А., Прохоров Б.М., Вайсман М.А. и др. Возможности сегидрина в улучшении качества жизни онкологических больных с хронической болью. Паллиативная медицина и реабилитация. 2004; 3: 35–7.
6. Палехов А.В., Данильян В.М., Введенская Е.С. Некоторые способы повышения эффективности противоболевой терапии в паллиативной онкологии. Паллиативная медицина и реабилитация. 2016. 2: 50-54.
7. Палехов А.В., Осипова Н.А. Пути решения основных проблем применения наркотических анальгетиков. Боль. 2008; 4:31-37.
8. Приказ Минздрава России от 16 ноября 2017 г. № 913 «Об утверждении методических рекомендаций по определению потребности в наркотических и психотропных лекарственных средствах, предназначенных для медицинского применения» http://www.consultant.ru/document/cons_doc_LAW_284258/
9. Состояние онкологической помощи населению России в 2017 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А. Герцена филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2018.
10. Стражев С. В., Березанцев А. Ю., Карандеева Т. В., Дробязко А. А. Использование гидразина сульфата для оптимизации паллиативной медикаментозной терапии и улучшения качества жизни больных онкологического профиля. // Онкологическая колопроктология 2014; 2: 3-17.
11. Филов В.А., Гершанович М.Л., Ивин Б.А. и др. Лечение первичных опухолей головного мозга сегидрином. Вопросы онкологии 1994; 40(7–12): 332–6.
12. Филов В.А., Гершанович М.Л., Стуков А.Н. Сегидрин – препарат для лечения онкологических больных. СПб. 2002. 20 с.
13. Bohnert et al. Reducing Unintentional Opioid Overdose by Improving Prescribing Practices. JAMA 2011; 305:315;
14. Breivik H., Cherny N., Collett B., de Conno F., Filbet M, Foubert AJ, et al. Cancer-related pain: a pan-European survey of prevalence, treatment, and patient attitudes. Ann Oncol. 2009; 20: 1420-33.
15. Cherny N.I. The management of cancer pain. CA Cancer J Clin. 2000; 50: 70-116.
16. Dunn K.M., Saunders K.W., Rutter C.M., et al. Overdose and prescribed opioids: Associations among chronic non-cancer pain patients. Annals of internal medicine. 2010;152(2):85-92;
17. Gomes T., Mamdani M.M., Dhalla I.A., Paterson J.M., Juurlink D.N. Opioid dose and drugrelated mortality in patients with nonmalignant pain. Arch Intern Med. 2011;171:686-91. [PMID: 21482846] doi:10.1001/archinternmed.2011.117
18. Hearn J., Higginson I.J. Cancer pain epidemiology: a systematic review. In: Bruera ED, Portenoy RK, editors. Cancer pain: assessment and management. London: Cambridge University Press; 2003. p. 19-37. 3. Jost LM, ESMO Guidelines Task Force. ESMO minimum clinical recommendations for the management of cancer pain. Ann Oncol. 2005; 16: i83-5.
19. Reis-Pina P., Lawlor P.G., Barbosa A. Adequacy of cancer-related pain management and predictors of undertreatment at referral to a pain clinic. J Pain Res. 2017; 10: 2097–2107.
20. van den Beuken-van Everdingen M.H., Hochstenbach L.M., Joosten E.A., TjanHeijnen V.C., Janssen D.J. Update on Prevalence of Pain in Patients with Cancer: Systematic Review and Meta-Analysis. J Pain Symp Man. 2016 Jun; 51(6): 1070–1090.
21. Zedler B., Xie L., Wang L. et al. Risk Factors for Serious Prescription Opioid-Related Toxicity or Overdose among Veterans Health Administration Patients, Pain Medicine, 2014; Volume 15, Issue 11: 1911–1929.